Per conoscere e rispettare l’ambiente acquatico non è necessario essere dei provetti chimici, tuttavia torna sempre utile sapere qualcosa di chimica in acquario e di cosa si parla precisamente quando si ha a che fare con cose esotiche tipo “le ossidoriduzioni” o concetti apparentemente semplici come il celebre “pH”. Sapete cos’è il pH? Se vi dico che è il logaritmo dell’inverso della concentrazione idrogenionica, vi ho aiutato? Andiamo con ordine e (spero) arriveremo a capire qualcosa su questo e altre cose ancora. Atomi Abbiamo tutti un concetto più o meno corretto di cosa è un atomo. Vi ricordo che sono le unità più piccole che compongono la materia e che sul nostro pianeta ce ne sono, a meno di esperimenti di alta fisica, 92 diversi. Visto che nella mia carriera acquariofila non mi sono mai imbattuto in intossicazioni da Vanadio o in centraline che somministrano il Cromo ai pesci, vi consolo dicendo che a noi acquariofili ce ne interessano principalmente quattro, i più importanti per la vita: Ossigeno (O), Carbonio, Idrogeno (H) e Azoto (N, da Nitrogenus). Nel caso dell’acquariologia marina hanno un loro importante ruolo anche i metalli alcalino-terrosi (calcio, magnesio, ecc.). Un atomo contiene, quando se ne sta buono, un numero X di protoni e un uguale numero X di elettroni (dei neutroni ce ne frega poco o niente). Questo X, il famoso Numero Atomico, è in fin dei conti l’unica cosa che differenzia un atomo da un altro e che ne determina tutte le proprietà. X è 1 per l’ Idrogeno, 6 per il carbonio, 7 per l’azoto e 8 per l’ossigeno. Ogni protone porta su di se una carica positiva (+) e ogni elettrone una negativa (-), cariche che si annullano a vicenda dal punto di vista della carica netta dell’atomo stesso. L’idrogeno p.e. ha un protone carico positivamente intorno a cui ruota un elettrone carico negativamente; la reciproca attrazione positivo-negativo tiene insieme l’atomo, cioè fa sì che elettrone e protone non se ne vadano ognuno per i fatti suoi, ma al di fuori dell’atomo eventuali altre particelle cariche (che quindi subiscono l’attrazione o la repulsione di altre particelle cariche) non percebirebbero apprezzabili campi elettrici dato che ci sono un uguale numero di cariche + e -. Tuttavia (per fortuna) ben di rado gli atomi si accontentano di starsene come la tavola periodica li vorrebbe e tendono a fare “commercio” di elettroni con altri atomi. Anche tra atomi uguali: difatti i tre elementi che ho nominato (Idrogeno, Ossigeno, Azoto) allo stato gassoso sono formati da molecole biatomiche; noi respiriamo quindi una miscela di N2 e O2. Prima di andare avanti preciso che per motivi di impaginazione sono costretto ad utilizzare grafie poco felici tipo Ca++, O– o H2O. Per correttezza, bisognerebbe scrivere ai piedi del simbolo dell’elemento i numeri e in apice i segni di carica, all’incirca in questo modo:
Gli ioni e le molecole Il comportamento peculiare dell’atomo ossigeno può essere un buon esempio per introdurre in maniera elementare il concetto di legame. Gli atomi di ossigeno sono avidi di elettroni altrui. Quando trovano un altro elemento che non è troppo affezionato ai propri, che so, il calcio (Ca), glieli rubano (sto usando terminologie… divulgative per dare un’idea: la chimica seria non è così approssimativa!). Un ‘ossigeno’ (abbreviazione per ‘atomo di ossigeno’) è al massimo della gioia quando si prende due elettroni in più rispetto a quelli che ha quando è neutro, in quanto in questo stato (quello con due elettroni in eccesso) è più stabile; in tali condizioni l’atomo si porta due cariche negative non più controbilanciate da quelle positive dei protoni e neutro non è più. Un atomo che ha una carica netta viene detto “ione”. Ione per eccellenza è l’ H+, che a ben vedere è un “semplice” protone. Difatti avevamo detto che il Numero Atomico dell’idrogeno era 1, ciò significa che è composto da un solo protone e da un elettrone che vi orbita attorno. La nostra storia dell’ ossigeno avaro potrebbe terminare con il nostro O– (ossigeno con due cariche negative) che decide di farsi compagnia con il Ca++, il quale ha perso la neutralità a seguito dell’aggressione dell’ossigeno. Dato che gli opposti si attraggono, il + attrae il – e abbiamo una molecola di CaO, (ossido di calcio o ‘calce viva’). La molecola è neutra: contiene tanti elettroni quanti protoni. Ricordo che per molecola si intende la frazione più piccola di una sostanza che possiede le caratteristiche stesse della sostanza. Per chiarire questo concetto con l’esempio della calce viva appena affrontato, si può dire che un quintale di CaO reagisce con l’acqua allo stesso modo – seppure, ovviamente, non con gli stessi effetti – di come lo fa una sola molecola. Se invece spezzo la molecola in un Ca++ e un O–, questa ha perso la sua identità e non ha più le caratteristiche della calce viva. Un’altro tipo di reazione l’ossigeno può averla con l’idrogeno per formare la vecchia cara acqua. Scommetto che adesso siete diventati bravi e avrete capito che l’idrogeno cede volentieri un elettrone all’ossigeno dando vita a un H+ e a un O-, i quali con tutta probabilità si appiccicheranno uno all’altro. Questo OH (inesistente in natura perché totalmente instabile) è molto ansioso di trovare un’altro atomo che gli ceda un elettrone per formare il più stabile ‘ione idrossido’, OH- (uno ione formato da due molecole! Ma dove andremo a finire?). Questo idrossido può a sua volta fare comunella con l’atomo che gli ha ceduto l’elettrone. Se è un’altro idrogeno, si formerà l’acqua (H2O, ma questo lo sapevate). Ci sono un sacco di molecole formate dallo ione idrossido, le famose ‘basi’, una su tutte l’idrossido di sodio NaOH, per gli amici ‘soda caustica’. Difatti anche il sodio è uno degli atomi più incline a cedere elettroni: quando si trova nello stato metallico esplode violentemente a contatto con l’acqua a causa di questa sua grande reattività. Ecco che torna il concetto di molecola e di proprietà degli elementi: il sodio metallico (Na neutro) esplode perché può cedere un elettrone, lo ione sodio (Na+) non può farlo. Ecco perché mettendo il sale (cloruro di sodio) nell’ acqua della pasta non è mai esplosa nessuna cucina… Il metodo con cui due atomi si tengono insieme va sotto il nome di “legame”. Ce ne sono di vari tipi. Quello che abbiamo appena visto è il più semplice (… e il meno corretto dal punto di vista della precisione scientifica) e viene detto ‘legame ionico’ in quanto si forma in seguito all’attrazione tra le cariche elettriche di due ioni. In questa trattazione poco ci cale dei legami metallici, dei ponti idrogeno o delle oscure forze di Van Der Waals; però un’altra importante categoria, il legame covalente, cercheremo di ridurla forzatamente ad una forma un pò particolare di legame ionico. I numeri di ossidazione Il concetto di numero di ossidazione viene considerato superato dalla chimica moderna, ma presenta l’indubbio vantaggio di una certa chiarezza e semplicità espositiva per gli argomenti che andiamo ad affrontare. Abbiamo appena detto che l’ossigeno “tende a portarsi nella configurazione O–“. In maniera più corretta diciamo invece che l’ossigeno “ha numero di ossidazione -2”. Nelle tavole periodiche a volte sono riportati gli stati di ossidazione dei vari elementi. Ricapitoliamo dicendo che: L’idrogeno ha un solo elettrone, e per di più tende a cederlo (H+). Quindi ha numero di ossidazione +1. Ignoriamo per i nostri scopi lo stato di ossidazione -1. L’ossigeno tende a diventare O–, cioè a rubare due elettroni: ha numero di ossidazione -2. Il carbonio fa talmente tante cose da far diventare pazzi; però di solito lo troviamo nell’acquario (vedete che ci arriviamo?) sotto forma di CO2 o ione carbonato (CO3–) quindi potete considerarlo come amante della configurazione C++++ (numero di ossidazione +4). L’azoto è già più problematico, in quanto nella chimica d’acquario è protagonista della nota reazione di ossidoriduzione: NO2- (nitrito) —> NO3- (nitrato) cioè passa dal primo stato, in cui ha numero di ossidazione +3, al secondo, in cui ha +5. Queste reazioni in cui si cambia numero di ossidazione si chiamano “ossidoriduzioni” e hanno un’enorme importanza. Per complicare ancora più la questione, considereremo che nell’ammoniaca e nello ione ammonio abbia numero di ossidazione -3. Mi seguite ancora? Sfrutto l’appena citato ammonio per un ripassino: esso è composto da: 1) Un atomo di azoto con carica —, cioè con 3 elettroni di troppo rispetto allo standard; Nelle molecole “simmetriche”, tipo H2, N2 o O2, lo stato di ossidazione va considerato 0. I motivi di ciò esulano dagli scopi di questa trattazione. Domandina facile facile: se l’ossido di potassio (K, da Kalium) ha formula K2O, qual è il numero di ossidazione del potassio? Reazioni chimiche La parte divertente (o insopportabile, dipende dai gusti) della chimica sono le reazioni. NaOH + HCI ——–> NaCI + H2O Che possiamo dire? 4 Fe + 3 O2 ——–> 2 Fe2O3 Fe è il simbolo chimico del ferro (… abbastanza intuitivo). Quello che ho scritto vuole dire, se non si capisse: “quattro atomi di ferro e due molecole di ossigeno gassoso reagiscono per dare due molecole di ossido di ferro (ruggine)”. Qui si fanno due conti e si nota che i numeri di ossidazione cambiano eccome tra prodotti e reagenti! Non mi addentro nell’ambito delle reazioni redox perché la confusione può arrivare a livelli stratosferici… Altro esempio, più acquariofilo: vi ricordate che vi si è detto di provare a versare delle gocce di acido muriatico (cloridrico) sulle rocce per vedere se sviluppavano bollicine, nel qual caso contenevano calcare (carbonato di calcio CaCO3) e non erano buone per l’acquario? Ecco quello che succede: CaCO3 + 2 HCI ——–> CaCI2 + H2O + CO2 Le bollicine sono dovute alla CO2, l’amata-odiata anidride carbonica, che “sfrizza”… In questo caso la reazione, come si vede, non è redox. Piccola curiosità: gli acidi che si comprano sono in realtà sempre soluzioni acquose degli stessi. L’acido cloridrico puro è gassoso! Peso atomico e peso molecolare Come tutta la materia, anche atomi e molecole nel loro piccolo hanno una massa. Ricordo che in chimica si usino indistintamente i termini massa e peso, intendendo però sempre massa, ossia quantità di materia. L’Unità di Massa Atomica (UMA) è assimilabile al peso di un protone: 1,66 x 10^(-24) g ( ^ = elevazione a potenza) ossia 0,0000000000000000000000166 grammi. Molto più comodo UMA, non trovate? Per quanto riguarda il peso degli interi atomi, si trascura bellamente il contributo dei leggerissimi elettroni ma non possiamo più ignorare quello dei neutroni (identico a quello dei protoni). A occhio e croce il peso atomico di un elemento è circa il doppio del numero atomico, in quanto gli atomi hanno di solito tanti protoni quanti neutroni: l’ossigeno avrebbe quindi peso atomico 16. In realtà ha 15,9994 – un valore non intero in quanto considerato “medio”, perché una certa percentuale di atomi di ossigeno ha meno di otto neutroni (… di certo non può avere meno di otto protoni, altrimenti ossigeno non sarebbe più!). Altro esempio: il Cloro ha numero atomico 17, quindi ha 17 protoni e -dovrebbe- avere 17 neutroni per un peso atomico di 34; ha invece 35,453 – il che suggerisce che buona parte degli atomi di cloro abbia più dei canonici 17 neutroni. Eccezione importante alla regola Peso = Numero atomico x 2 è data dall’idrogeno: il 99% dei nuclei di idrogeno contiene solo un protone (“pròzio”), contro lo 0,016% di ‘deuterio’ che contiene un protone e un neutrone. Perciò il peso atomico dell’idrogeno è molto vicino a 1. Gli atomi con uguale numero atomico ma diverso perso atomico vengono detti “isotopi”. La concentrazione Ci sono dozzine di sistemi per indicare in che quantità un soluto è disciolto in un solvente. Uno semplice può essere rappresentato dai “grammi per litro”: se sciolgo in cinque litri d’acqua tre etti di sale dirò che la soluzione acqua-sale ha una concentrazione grammi/litro di (300/5) = 60 g/l. Come tutte le cose comode ai chimici questo tipo di concentrazione non piace e si preferisce utilizzare la “molarità” che ha il pregio di essere rappresentativa della quantità di molecole, piuttosto che del loro peso. Introduciamo il concetto di mole. Una mole è una quantità numerica, come la dozzina. E’ solo un pò più grande: vale 6.02 x 10 ^ 23 cioè circa 602000000000000000000000. Questo è il cosiddetto Numero di Avogadro. Ecco che si introduce facilmente la molarità, che rappresenta le Moli per Litro di soluzione. Quesitino: se sciolgo in 25 litri d’acqua un chilo di ammoniaca pura, qual’è la molarità della soluzione? Il peso molecolare dell’ammoniaca è circa 17. Quindi 1000 grammi / 17 fornisce un valore di 58.82 moli. Dividendo per venticinque otteniamo la molarità, 2.35 . Diciamo quindi che la soluzione ottenuta ha una molarità di 2.35, o per fare i professionisti diciamo “è 2.35 molare”. Le concentrazioni molari si indicano con delle parentesi quadre, ad esempio indichiamo la concentrazione dell’ammoniaca con [NH3]. La costante di equilibrio Ho avuto la tentazione di inserire subito l’argomento pH, ma sono un pò sadico e lo posticipo al discorso dell’equilibrio chimico, che va necessariamente introdotto partendo dalle reazioni incomplete. Un esempio di reazione completa è quella che porta un acido cosiddetto “forte” a dissociarsi completamente in soluzione acquosa: HCI (in soluzione) —-> H+ + CI- In soluzione non troverete praticamente mai dell’acido cloridrico indissociato, ma i singoli ioni che, complice l’acqua, vanno ognuno per i fatti suoi. In pratica se aggiungiamo a questa soluzione dell’acido nitrico, un altro acido forte, si dissocerà completamente anche questo cosìcché sarebbe impossibile stabilire a quale acido appartenevano originariamente gli H+ liberi. NH3 + H2O <——> NH4+ + OH- non porta ad una rapida e completa trasformazione dell’ammoniaca in idrossido di ammonio (o meglio, idrossido E ammonio); difatti l’ammoniaca che si compra in flaconi al supermercato contiene in parte NH3 gassosa disciolta e in parte ammonio + idrossido. Nel nostro flacone c’è una situazione di equilibrio dinamico: in continuazione molecole di ammoniaca si trasformano in idrossido di ammonio e altrettante molecole di idrossido di ammonio ridiventano ammoniaca. Ecco perché la doppia freccia nella reazione. C’è, istante per istante, una precisa concentrazione di OH-, una precisa concentrazione di NH3 e una precisa concentrazione di NH4, ma le molecole non sono per se stesse immutabili. La Costante di Equilibrio è una grandezza che caratterizza “quanto è andata avanti” una reazione; se abbiamo una reazione in equilibrio pA + qB <——> rC + sD (p,q,r e s sono i coefficienti!) la costante di equilibrio vale [C]^r x [D]^s Ossia il rapporto tra il prodotto delle concentrazioni dei prodotti e il prodotto delle concentrazioni dei reagenti, con tutte le concentrazioni elevate al rispettivo coefficiente (forse è più chiaro sopra). Esempio in soldoni: per la dissociazione in acqua dell’acido HCIO2 la costante di equilibrio (o, più precisamente, la ‘costante di dissociazione’) vale 0,011. Che significa? Significa che per la reazione HCIO2 <——> H+ + CIO2- si ha che [H+] x [ClO2-] Può sembrare un numero di poca utilità pratica, ma non è così. Vi ricordo che tutte le concentrazioni sono molari. La costante di equilibrio varia solo con la temperatura, quindi per i nostri scopi possiamo ignorare le sue variazioni e considerarla costante. Il pH (era ora) Cosa caratterizza tutti gli acidi? O meglio, cosa sono gli acidi? Gli acidi sono sostanze che in acqua cedono ioni H+. Le basi, similmente, sono sostanze che cedono OH-. Difatti, gli acidi hanno praticamente sempre formula del tipo HXAY (ossia: X atomi di idrogeno e Y atomi di qualcos’altro) mentre le basi hanno formula del tipo BXOHY (ossia: X atomi di qualcosa e Y gruppi idrossido). pH = – log [H+] dove log sta per logaritmo. Per i multipli di dieci, il logaritmo vale il numero degli zeri; per uno, vale zero. Da zero in giù, non esiste e le calcolatrici vi danno “errore!”. Per tutti gli altri numeri, vale qualcosa in mezzo… Una calcolatrice sarà quanto mai utile. Prendiamo un decimo di mole di HCI, ossia 3,65 grammi. In acqua si dissocia completamente, dando 0,1 moli (un decimo di mole) di ioni H+ e 0,1 moli di CI-. Se di acqua ne abbiamo un litro, abbiamo una soluzione 0,1 molare, cioé [H+]=0,1. Il logaritmo di 0,1 è -1, quindi il pH della soluzione è il suo inverso, cioè 1. La cosa principale da tenere a mente è che se il logaritmo di un valore cambia di 1, il valore stesso cambia di dieci volte! Una soluzione a pH 4 è 10 volte più acida (ossia ha il decuplo degli ioni [H+]) di una soluzione a pH 5 e 100 volte più acida di una soluzione a pH 6. Nel caso di acidi deboli, la situazione diventa più complicata e si ricollega alla costante di equilibrio. La “reazione”, in questo caso, è la dissociazione dell’acido: HCN <—> H+ + CN- Già, perché un acido debole in acqua non si dissocia completamente; abbiamo in soluzione sia la molecola “intera” che la versione “spezzata”. Possiamo quantificare la dissociazione, come nel caso del HCIO2 che abbiamo visto prima, tramite la costante di equilibrio. Dato che [H+] e [CN-] sono uguali, si ha [H]^2 ( <== [H+] al quadrato, ossia [H+]x[H+] = [H+]x[CN-] ) Da cui [H+]= radice quadrata di K x [HCN]. Ecco il… punto di non ritorno: purtroppo non posso fare a meno di utilizzare certi formalismi matematici. Sorry. Torniamo a bomba: abbiamo la concentrazione di [H+], da cui tireremo fuori il pH, semplicemente conoscendo la costante di dissociazione dell’acido e la concentrazione di quest’ultimo. I più attenti si saranno accorti che la concentrazione di HCN in realtà… non ce l’ho: quella nella formula è la concentrazione DOPO il raggiungimento dell’equilibrio. In realtà faccio un errore volontario, perché so che la variazione RELATIVA della concentrazione è assai poca. Vi ricordo ancora che gli equilibrio sono dinamici: in continuazione molecole di acido si dissociano e altrettante se ne formano. Il pOH e la costante del prodotto ionico dell’acqua (!) Il pOH è definito proprio come il pH, tranne che nel caso del pOH la concentrazione che andiamo a misurare non è quella degli H+ ma quella degli OH-. H2O <—-> H+ + OH- Per quantificare questa reazione, usiamo la formula della costante di equilibrio, un po’ modificata: Kw = [H+] x [OH-] Questa costante, il prodotto ionico dell’acqua, vale 10^-14, e proprio come una costante di equilibrio dipende solo da fattori fisici (tipo la temperatura). Nell’acqua neutra, dato che ci sono tanti H+ quanti OH-, si ha [H+] = [OH-] = 10^-7 (difatti pH neutro=7) Cosa comporta tutto ciò? Che se io nell’acqua porto la concentrazione dell’idrogeno a 10^-4 (ad esempio aggiungendo un acido forte fino ad una concentrazione molare di 0,0001) avrò che la concentrazione di [OH-] scendera a 10^-10. In termini più semplici e chiari, la somma del pH e del pOH è sempre pari a 14. Perciò, data una soluzione a pH 9, sarebbe più corretto pensarla come una soluzione il cui pOH è 5; dopotutto il carattere basico è dovuto all’abbondanza di OH-,e non alla scarsità di H+. L’equilibrio della CO2 Cosa succede quando mettiamo la CO2 nell’acquario? Che si formano un sacco di prodotti particolari. Innanzitutto la CO2 reagisce con l’acqua: CO2 + H2O <—–> H2CO3 (equilibrio!) Il quale, a sua volta si dissocia: H2CO3 <—–> H+ + HCO3- (equilibrio! E due!) La costante di ionizzazione di quest’ultima reazione (ossia la costante di equilibrio della reazione di dissociazione) vale 4.3 x 10^-7. Fino adesso, quindi, abbiamo nell’acqua CO2 gassosa, protoni (cioè ioni H+) che abbassano il pH e ioni bicarbonato, che aumentano il KH. Anche gli ioni bicarbonato, in piccola parte, si dissociano: HCO3- <—–> H+ + CO3– (ancora equilirio! aaargh!) Tanto per la cronaca, i famosi gradi tedeschi vengono usati solo in acquariofilia! Altrove si usano solo gradi francesi e gradi USA.
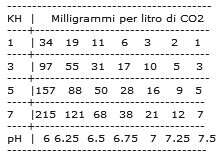
Consideriamo, che so, il punto pH 7-KH 5. Abbiamo una concentrazione di 16 mg/l di anidride carbonica. Mettiamo di voler abbassare un pò il pH per quei caracidi sudamericani tanto colorati che vogliamo comprare. Il buon senso ci dice di aumentare l’anidride carbonica; cosa provoca quest’aumento di CO2? Innanzitutto guardiamo la prima reazione, quella di dissociazione della CO2. Visto che è aumentata la concentrazione di CO2, e visto che la costante di equilibrio NON può variare, affinché l’equilibrio sia conservato si avrà un aumento di H2CO3, acido carbonico, in soluzione. La dissociazione dell’acido carbonio abbassa il pH e aumenta la durezza carbonatica; rispetto però ai sali già disciolti, l’aumento di KH causato dall’anidride carbonica è trascurabile. Notate che all’aumentare del KH, serve sempre più CO2 per abbassare il pH. Perché? La ragione può essere compresa guardando la formula detta prima e ricordando che la costante di equilibrio è appunto, costante. Quindi: Il rapporto tra le concentrazioni dei prodotti ( H+ e HCO3-) e dei reagenti (H2CO3) è costante ====> in soluzione è già presente un pò di HCO3- dovuto ai sali disciolti ====> se la reazione di dissociazione ignorasse la presenza degli ioni bicarbonato preesistenti, avremmo a parità di reagente una maggiore quantità di prodotti ====> questo è in contrasto con l’invariabilità della costante di equilibrio ====> a parità di reagenti si formano meno prodotti, cioè meno H+ ! Per gli stessi motivi, un acquario in cui il pH è relativamente basso è meno avido di CO2: a causa della presenza di H+ in soluzione, l’acido carbonico è “poco invogliato” a dissociarsi come bicarbonato e idrogeno e resta disponibile per le piante. Per concludere, svelo l’arcano dell’effetto tampone del bicarbonato. Esso può reagire con gli acidi, così H+ + HCO3- <—> H2CO3 ma anche con le basi: OH- + HCO3- <——> H2O + CO3– In entrambi i casi, gli H+ e gli OH- indesiderati vengono tolti di mezzo. Anche il sangue utilizza bicarbonato come tampone. |
Messaggio precedenteUn lago in casa vostra - Informazioni sui ciclidi del lago Malawi
Next PostZeovit - Considerazioni dopo due mesi di utilizzo