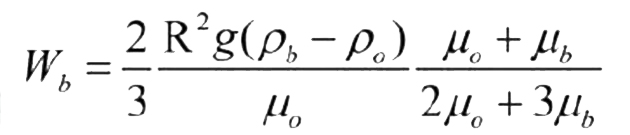La vera evoluzione dell’acquariofilia marina è legata all’apparizione dei primi schiumatoi veramente efficienti ed “all’invenzione” del berlinese che rese obsoleti, da un giorno all’altro, i vecchi sistemi basati su filtro esterno e sotto-sabbia. Studi approfonditi sulle biocenosi coralline tropicali mostrarono l’incredibile simbiosi con Dinofite del genere Zooxantella e l’importanza delle cromoproteine nei processi fisiologici degli Antozoi. L’obiettivo divenne il controllo dei nutrienti, nonché delle sostanze ingiallenti. D’improvviso quindi lo schiumatoio divenne la soluzione a tutti i problemi. Lo sviluppo degli schiumatoi, da allora, si è svolto in alcuni casi in modo empirico, in altri casi seguendo teorie più o meno solide, in altri ancora del tutto casualmente, con prove successive prive di una reale idea e di un vero progetto. La schiuma all’interno del cilindro automaticamente dava la certezza, spesso illusoria, del funzionamento. La comprensione dell’importanza di avere una buona colonna di contatto, di un’interfaccia estesa aria-acqua e quindi di bolle di ridotte dimensioni, lo studio dei materiali, delle giuste proporzioni, dell’idrodinamismo all’interno della camera, tutto ciò ha permesso la creazione di prodotti maggiormente efficienti, compatti e versatili. Lo studio dettagliato di questi processi si è avuto nei primi anni novanta ad opera di Gregory and Zabel (1990), Lawson (1994), Timmons (1994) e Summerfelt (stampe). Alcuni esempi di composti organici: Come si può ben comprendere, esiste un’infinità di molecole organiche dalle proprietà chimiche, fisiche e biologiche più disparate. In mare queste molecole sono rinvenibili in varie forme che possono essere divise facilmente, in base alla granulometria, in sostanza organica disciolta e sostanza organica particellata. La prima, detta DOM, comprende particelle delle dimensioni inferiori a 0,5µm; la seconda, detta POM, è costituita da particelle più grossolane.
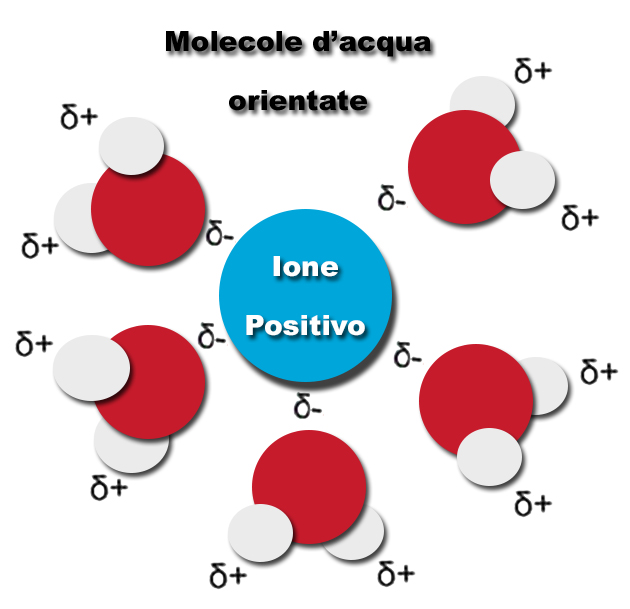
Il materiale organico, alimento per coralli e pesci, se in eccesso, diviene fonte di nitrato e fosfato. Questi possono trovarsi sia in forma organica sia inorganica; parleremo quindi di azoto totale sul particolato (P.N.), azoto totale disciolto (T.D.N.) e azoto inorganico (T.D.I.N.), così come di P.P. (fosforo totale sul particolato), T.D.P. (fosforo totale disciolto) e Fosforo inorganico. Azoto e fosforo in forma organica sono eliminati dallo schiumatoio. Le forme inorganiche quali ammoniaca/ammonio, nitriti, nitrati, ortofosfati, sono fortemente legate alle molecole d’acqua risultando quindi non estraibili.
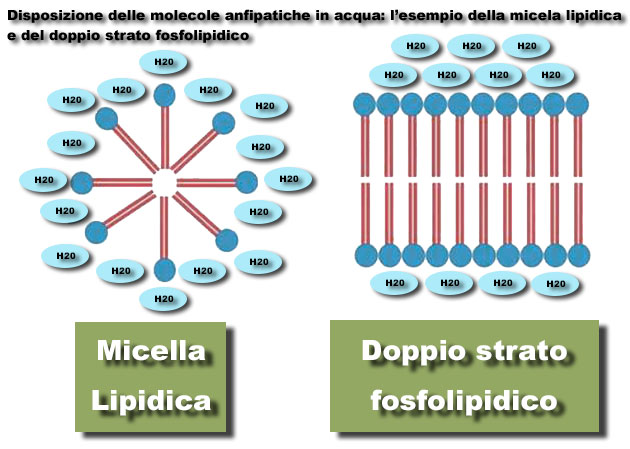
Un esempio classico sono le proteine, i fosfolipidi, acidi grassi e saponi. Le membrane cellulari ad esempio, sono in larga parte costituite da sostanze anfipatiche: la struttura a doppio strato fosfolipidico permette di separare ambiente esterno e interno delle cellule. Le sostanze anfipatiche tipicamente sono caratterizzate da una testa idrofila che forma legami ad idrogeno con l’acqua e da code idrofobe che sfuggono da essa. In acqua formano, oltre al già menzionato doppio strato fosfolipidico, anche degli aggregati detti micelle ove le sostanze anfipatiche (definibili tensioattivi) si posizionano con le code apolari tutte rivolte verso il centro della micella e con le teste rivolte verso il solvente acquoso.
Si forma così un’area centrale idrofoba chimicamente stabile. Perchè una micella si formi è però necessario superare forze di repulsione normalmente presenti nelle aree apolari delle molecole e si indica come “concentrazione micellare critica”, o CMC, la concentrazione di tensioattivo minima necessaria alla formazione delle micelle.
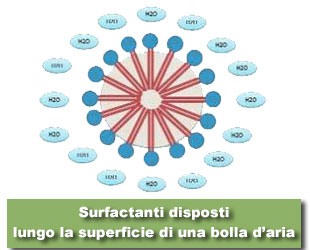
Questa disposizione rende le bolle d’aria delle vere e proprie superfici adsorbenti che permettono la raccolta e l’ancoraggio del materiale organico. Molecole diverse avranno affinità diverse per l’interfaccia aria/acqua: non tutte le molecole quindi legheranno la superficie delle bolle allo stesso modo e tra esse vi sarà una sorta di competizione per lo spazio disponibile sull’interfaccia. Questo fenomeno è reso ancora più importante se si considera che i tensioattivi, detti anche surfactanti, non possono fare altro che disporsi in monostrato attorno alla bolla. Alla luce di quanto spiegato circa il rapporto superficie/volume è necessario comprendere quanta aria immettere nello skimmer al fine di ottimizzare il numero e la dimensione delle bolle e rendere performante il suo funzionamento. È necessario cioè immettere la “giusta” quantità di aria poiché vi è una proporzione aria/acqua che dipende da una serie di variabili tra cui salinità e temperatura dell’acqua. Immettendo poca aria avremo una schiumazione inefficiente per ridotta superficie di interfaccia, immettendo troppa aria avremo un fenomeno di bubble merging: le bolle, troppo vicine le une alle altre, acquistano sufficiente forza da fondersi in bolle di dimensioni maggiori e con superficie utile totale minore.
Avere bolle piccole, oltre ad aumentare la superficie di interfaccia, permette di aumentare decisamente il tempo di contatto tra la bolla stessa e l’acqua. Bolle piccole infatti possiedono una minore velocità di risalita. Mediante l’equazione di Hadamard-Rybczynsk (derivata dell’equazione di Stokes) è possibile quantificare la velocità di una bolla sferica ipotetica che si muove in un ambiente fluido. Nel dettaglio:
R è il raggio della bolla. Si può facilmente intuire come al diminuire di R, cioè del raggio della bolla, la velocità diminuisca. Alcuni autori reputano che il raggio delle bolle diminuisca con l’aumentare della concentrazione di sostanze schiumabili, in particolare proteine (Chen et al. 1992).
È importante considerare che se da un lato un tempo troppo breve non permette l’adesione dei surfactanti alla superficie di interfaccia, un tempo di contatto troppo lungo rischia di peggiorare la qualità della schiumazione. Tempi di contatto troppo lunghi porterebbero ad una selezione dei surfactanti adesi alla bolla: le specie chimiche meno affini all’acqua si legherebbero meglio e in maggiore quantità riportando in soluzione specie chimiche maggiormente idrofile. Questo fenomeno porta all’eliminazione solo di alcuni tipi di sostanze esponendo l’ecosistema al pericolo di accumulo selettivo di talune molecole. A questo proposito è necessario, per un corretto funzionamento degli skimmers, prevedere un’area di relativa “calma” idrodinamica alla base del collo dello schiumatoio ove le bolle iniziano il processo di accumulo e di formazione della schiuma vera e propria.
Quali sono quindi le molecole realmente raccolte ed estratte dallo schiumatoio? In allevamento più autori (Timmons, 1994) reputano lo schiumatoio capace di estrarre unicamente molecole al di sotto dei 30 ?m. Chen et al. (1992) hanno dimostrato come il diametro medio delle particelle, in allevamenti intensivi, sia di 10.6 ?m. Altri autori, occupandosi di trattamento acque reflue e metallurgia reputano gli schiumatoi capaci di estrarre anche particolato grossolano (Conway and Ross, 1980; van der Toom, 1987). La nostra personale esperienza mette in luce come la maggior parte delle molecole organiche anfipatiche siano facilmente schiumate. In questa categoria inseriamo sia DOM che POM; non soltanto le piccole molecole, i batteri e il phytoplancton, ma anche il detrito, lo zooplancton e la materia organica grossolana sono presenti nello schiumato. È possibile inoltre estrarre particelle inorganiche e minerali come ad esempio polveri di carbone, particellato derivante dalle resine antifosfati etc … L’estrazione delle molecole organiche determina non solo la limitazione dei nutrienti ma anche l’eliminazione di tutta una serie di sostanze non desiderate come tossine e sostanze ingiallenti (CDOM). Nitriti, nitrati e fosfati non sono estratti dagli schiumatoi. Studi scientifici hanno evidenziato una presenza nello schiumato di altri ioni: calcio, sodio, silicio, ferro, alluminio, iodio ecc. Questi provengono in gran parte da materiale organico o organicato. Molti metalli infatti possono complessare con molecole organiche (acidi umici, alcuni flocculanti ecc.) ed essere schiumati (Eisma, 1986, Liss et al. 1975). Questo processo, se da un Iato può abbattere alcuni oligoelementi, dall’ altro permette di tenere sotto controllo alcuni eventuali metalli pesanti (es.: rilascio di ferro da parte delle resine antifosfato a base ferrosa). Anche il fosfato inorganico può rientrare, in alcuni casi, nello schiumato (Tri, 1975): può complessare con molecole di carbonato di calcio formando un composto detto Apatite (Ca5(PO4)3[F, OH, Cl]).
Dallo schiumato sono invece escluse tutta una serie di piccole molecole organiche particolarmente idrofile come ad esempio zuccheri semplici, gli ossalati, alcuni alcoli, e l’acetato. La non estrazione di questi composti è alla base delle tecniche a proliferazione batterica, eredi della vecchia tecnica della VODKA. Queste sostanze non schiumabili, possono essere dosate come fonti di carbonio utili alla proliferazione batterica; i batteri, al contrario, sono facilmente allontanati dal “sistema acquario” mediante schiumazione.
La formazione della schiuma è un processo che avviene nella parte alta degli schiumatoi, per la precisione a partire dall’imboccatura del collo. Le bolle si ritrovano una vicino all’altra, ricche di materiale organico, ed iniziano ad interagire. Queste iniziano a fondersi diventando sempre più grandi e contemporaneamente viene eliminata parte dell’acqua residua tra le bolle stesse. Questo processo è detto in gergo “asciugatura”. Si forma un vero e proprio patchway di strati successivi di aria, materiale organico ed acqua. Maggiore sarà l’eliminazione dell’acqua residua, più densa sarà la schiuma; questo tipo di schiumazione viene definita “secca” o asciutta. La sostanza organica “catturata” dalle bolle tende ad agglomerarsi formando un particellato dall’aspetto fangoso. Tale sostanza ricca di organico, deve essere necessariamente schiumata in un acquario ben gestito. Sono le bolle che arrivano dal basso, dalla colonna di contatto, che permettono a questa sostanza particellata di tracimare all’interno del bicchiere per essere poi eliminata. È evidente, per quanto prima illustrato, che l’efficienza di uno schiumatoio è legata a come viene “lavorata” l’acqua all’interno della colonna di contatto. Si deduce facilmente che una colonna di contatto di maggiore volume consente prestazioni superiori ed altrettanto facilmente si deduce che la forma cilindrica è e resta l’ideale in quanto quella conica, attualmente di moda, non solo a parità di impronta a terra riduce drasticamente il volume utile, ma addirittura “invita” al bubble merging. Uno schiumatoio ben progettato NON deve richiedere il livello dell’acqua in colonna al di sotto del collo del bicchiere (salvo casi eccezionali) ma, come detto sopra, deve sfruttare al meglio la colonna di contatto dove avviene la “raccolta” delle sostanze schiumabili. La progettazione del collo del bicchiere è strettamente legata al progetto generale e deve consentire, entro certi limiti, di scegliere la taratura ottimale lavorando sulla quantità di acqua trattata e di aria insufflata. Nel processo di formazione della schiuma osserviamo tanto maggiore accumulo di sostanza organica quanta ne è presente nel mezzo. Questo fenomeno può trarre in inganno un osservatore poco attento: schiumatoi poco performanti possono schiumare molto materiale in senso assoluto ma poco in relazione alla reale quantità di DOM e POM presenti in acquario. Questo fenomeno è reso evidente dall’incapacità di queste attrezzature di abbattere i nutrienti dando un accumulo cronico di nitrati e fosfati. Inoltre solitamente gli schiumatoi MAL progettati hanno un meccanismo di asciugatura della schiuma completamente inadeguato; questo causa esclusivamente uno schiumato bagnato e quasi sempre povero, in percentuale, di materia organica, con ovvie ripercussioni sulla salinità.
E finalmente la risposta alla domanda: “è meglio schiumare bagnato o asciutto”?
Ai fini della resa di uno schiumatoio è fondamentale, come dimostrato e ripetuto sopra, quello che avviene nella colonna di contatto. In essa le bolle raccolgono e trasportano verso l’alto le sostanze schiumabili. Arrivate al collo del bicchiere, inizia l’asciugatura. Quando la schiuma comincia a formarsi è oramai terminata la fase “di raccolta”. Se l’asciugatura è breve o inefficiente si raccoglie troppa acqua nel bicchiere (che porta con se oligoelementi, sodio, ecc., che sono utili al sistema); se la schiuma si asciuga troppo si ha un accumulo di “melma” nel collo, che spesso non permette la tracimazione (fenomeno connesso con il bubble popping, cioè l’esplosione delle bolle). In realtà, se consideriamo solo la raccolta di materiale organico, non cambia nulla. Sia che lo raccogliamo nel bicchiere con tanta acqua che sotto forma di melma nel collo, avremo ottenuto lo stesso risultato.
Bibliografia BIBLIOGRAFIA CONSIGLIATA Nel prossimo articolo: |