| L’Amazzonia è immensa. È molto, molto, difficile percepire l’interezza delle sue dimensioni anche avendola visitata. Dire: “sono stato in Amazzonia” avendo – come io ho avuto – la fortuna di esserci effettivamente andato dice tutto senza, in realtà, dire (quasi) nulla …
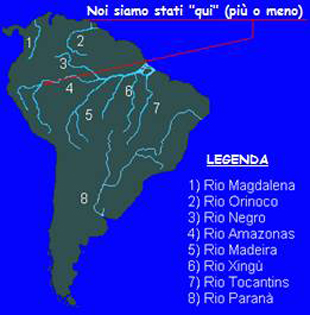
Il Rio delle Amazzoni ha una lunghezza totale di 6.518 Km: nasce nelle Ande peruviane (ad una quota di circa 5.200 m. s.l.m.) e, alla fine della sua corsa, riversa in Atlantico 175.000 m3 di acqua al secondo. Il bacino del Rio delle Amazzoni copre circa il 40% dell’intero Sud America occupando parti importanti di: Brasile (principalmente), Perù, Colombia, Ecuador, Venezuela e Bolivia. L’Amazzonia (il bacino fluviale e la foresta che vi insiste sopra) copre – approssimativamente – 2,5 milioni di chilometri quadrati (vista dall’alto, da un aereo che vola a quasi 1000 Km/h, sembra non finire mai) con – una volta lasciate le propaggini della Cordigliera andina, un altitudine media (sul livello del mare) di circa 200 metri. Tale situazione orografica si riflette, in modo significativo, sulla morfologia degli areali che il Rio Amazonas ed i suoi tributari incontrano nel suo cammino. La media delle precipitazioni dell’intero bacino è di 2.300 mm (annui) con punte, in determinati areali, di 6.000 mm: nella regione di Iquitos (Perù) si registra una variazione del livello del fiume pari a 12 metri! L’intera area, per la più parta coperta da fitta foresta, vive in un regime di forte stagionalità delle precipitazioni, e di annesse inondazioni di vaste porzioni di essa, che “trovano sfogo” in un complesso sistema fluviale che consta del Rio delle Amazzoni propriamente detto (il fiume assume tale nome dopo la congiunzione, in terra brasiliana, del Rio Negro con il Rio Solimoes), del numero infinito di suoi affluenti e della sterminata rete di paludi, lagune, acquitrini (spesso tra loro intercomunicanti) che tale sterminato sistema fluviale genera.
Il bacino amazzonico ospita, solo per dare un esempio della biodiversità che vi trova rifugio, 2.400 specie di pesci ovvero un numero superiore a quelle rinvenute nell’intero Oceano Atlantico! Quello degli insetti (intendo il numero delle specie) e non solo è, possibilmente, addirittura più elevato … • L’Amazzonia: la stagionalità della foresta pluviale, Il “ciclo delle stagioni” guidato, come visto, dal peculiare regime di precipitazioni prevede il periodo di “acqua alte” da Dicembre a Maggio e quello di “acque basse” da Luglio a Settembre e mostra, sintetizzando al massimo, il seguente iter:
Lo stato di cose appena descritto comporta – in passi successivi – quanto segue:
Quanto sopra (vedremo in seguito) ha effetti significativi sulla biologia riproduttiva dei pesci (di tutti, non solo i loricaridi) dell’Amazzonia, secondo il seguente, sommario, schema:
L’assunto che recita “l’acqua è Vita” trova – insomma – in questo ambiente una esaustiva dimostrazione. L’acqua è Vita e neppure la lunga – sovente feroce – stagione secca che caratterizza la zona riesce ad inficiare tale affermazione. A titolo di curiosità merita menzionare il peso parimenti elevato che le precipitazioni hanno su un altro, peculiare, areale di foresta tipico del Sud America: la Mesa Atlantica (Mesa = foresta), come ad esempio la Floresta da Tijuca (la “foresta urbana” più grande la mondo le cui attuali dimensioni – superficie di 32.000 Kmq, quindi più grande dell’intero Belgio – sono le vestigia della magnificenza che fu). La principale differenza tra questo tipo di foresta e quella amazzonica consiste nell’assenza di un marcata stagione delle piogge con presenza, in aggiunta, una elevata umidità diffusa durante tutto l’anno, garantita dalla vicinanza del mare. Si tratta di un ambiente che più della foresta amazzonica ha subito un forte l’impatto antropico,la già menzionata “Floresta da Tijuca” – che ho visitato – insinua le sue propaggini dentro la stessa Rio de Janeiro, e che sovente ha dovuto subire una errata ri-forestazione con piante alloctone (come il bambù) e/o l’introduzione di specie “aliene” (le carpe Koi sono ovunque …). Ma l’importanza dell’acqua, e delle piogge che la mettono a disposizione, non cambia (anche se le tempistiche sono, come visto, diverse). • L’Amazzonia: le mie esperienze nell’Amazzonia peruviana (Iquitos, distretto di Loreto) 22.07.00: Roma (aeroporto di Fiumicino): ci siamo, di nuovo, per fortuna … con la solita aria condizionata funzionante per “firma” attendiamo (su un jet Iberia) il permesso di andare: il Perù, via Madrid, ci aspetta. Il viaggio più lungo, costoso, complesso (per climi ed ambienti che andremo ad attraversare), intrigante, “spaventevole”, più tutto … sta per iniziare. Ore 22.50 (ora italiana) il sole splende, stiamo volando sulla sconfinata foresta amazzonica e cominciamo, per l’ennesima volta, a “fare carte” (ovvero a riempire i moduli di ingresso) ed infine (ore 19.30 locali) eccoci a bomba: Lima. Attraversiamo una città rumorosa, caotica e puzzolente (!) per alloggiare, nel quartiere residenziale di San Isidro, all’Hotel Del Pilar di un lusso, addirittura, sfrenato. Numero i rulli fotografici (per riconoscerli successivamente), poi … buona notte a tutti! 23.07.00: Scherzi del fuso orario: mentre noi siamo in piedi da due ore (06.30 del mattino, locali) Lima inizia, sonnacchiosamente, ad alzarsi. Il tempo, inverno australe, non promette molto. Il profilo che si vede dalle nostre finestre è di una metropoli di taglio “occidentale”, va aggiunto che ci troviamo in una zona residenziale molto “in”. Il nostro primo giorno in Perù è iniziato … Pomeriggio: Tour di Lima … la vista migliore è stato l’Oceano (Pacifico) e la baia avvolta in una nebbia ovattata. Poi la Cattedrale, Plaza Major, Convento di San Francesco … Eccellente il “ceviche” (piatto locale a base di pesce crudo e verdura) con salsa “pirica” ed annaffiatura di vino bianco. Da qui c’è un salto (per escludere, tutta la tratta andina senza meno interessante ma poco in linea con quanto andrò a descrivere) ed arrivare alla permanenza in foresta …. 29.07.00 (Iquitos): Siamo, infine, arrivati. Ieri sera cena folk; incluso spettacolo becero col serpente. Tra i piatti forti caimano (fritto) ed Arapaima. Purtroppo, a latere della stessa cena, devo registrare uno dei più gravi “disastri gastrici” di cui abbia memoria … Stamattina sto bene (circa) ma sono fiacco ed ho poca voglia di scrivere. Nonostante la fiacchezza abbiamo visitato l’odorosissimo (eufemismo) mercato di Belen, niente di realmente nuovo tranne l’uso “alternativo” di Oscar, Leporini, Pacu, Arowana ed altri pesci (che da noi si definiscono “da acquario”).
Si dice che qui, rivolgendosi alla fonte giusta, sia possibile reperire ogni e qualsivoglia tipo di mercanzia più o meno lecita, ovviamente ho evitato di approfondire! Mentre mi aggiravo per il mercato la mia attenzione è stata attratta da una bottega particolarmente “colorata” mi sono avvicinato titubante, per scattare una foto volendo, al tempo stesso, evitare di urtare la suscettibilità di qualcuno, … mentre, in cima a tre scalini in discesa posti all’ingresso, guardavo dubbioso mi sono sentito tirare lievemente il bordo della camicia … Abbasso gli occhi per incontrare lo sguardo di un bimbo locale mi apostrofa scherzosamente … “Hola, Gringo!”, inutile dire chi ho fotografato!
Jim L. (la nostra guida): indossa stivali “pitonati”; pantaloni “a cicca”, cinturone, cappello da cow-boy e, ultimo ma non ultimo, parla a “bocca larga” (come da stereotipo yankee). Risponde al soprannome di Jungle Jim. Un misto di colonialismo all’acqua di rose (spesso “spande” un po’ troppo i suoi dollari) e di concreta fattività (si prende cura dei figli dei membri dell’equipaggio pagando i loro studi e vendendo i prodotti dell’artigianato – prodotti dai genitori – in USA tra i suoi amici e, successivamente, inviando loro i ricavi). E’ un tipo strano caratterizzato da un misto di atteggiamenti alla “Pecos Bill” e di cultura acquariofila ed ittiologica oggettivamente assai elevata condita da una buona cognizione della realtà, oggettiva, in cui ci troviamo. Imprevedibile nei comportamenti nel complesso, sembra sapere cosa fare, vedremo … 30.07.00: sotto un cielo nuvoloso ma con ampi squarci di un azzurro intensissimo siamo pronti per partire. Sono eccitato e, anche, un po’ teso. Navighiamo, infine! Nel gruppo si sono: Jungle Jim (il capo) Professor Dick (75 anni! Appassionato di Apistogramma e di piante officinali), Senor Insecto (studioso di entomologia e, dichiaratamente, pronto a raccogliere tutte le cose più “schifide” della foresta), Barter Bob (appassionato di trekking ed abilissimo nei baratti con gli indigeni) e, per finire, io (appassionato di ciclidi) e Stefania capitati qui “per caso” … Un bel gruppo, niente da dire.
La nostra barca si chiama Tucunare che è – per inciso – il nome locale del Cichla ocellaris. E’ una imbarcazione a fondo piatto, capace quindi di un pescaggio ridottissimo, che sarà, nei giorni a venire la base di tutte le nostre attività: dormitorio, mensa, centro raccolta (classificazione e gestione dei campioni reperiti in campo), sala di lettura, studio e quanto di altro ci verrà proposto.
Dopo cinque ore di navigazione, dopo aver risalito parte del Rio Orosa eccoci al nostro campo base “Madre Selva II”. La giungla amazzonica è intorno a noi. Si va ad iniziare, davvero! Già so che il tempo sarà un solerte “camminatore” ma non posso farci nulla, quindi …
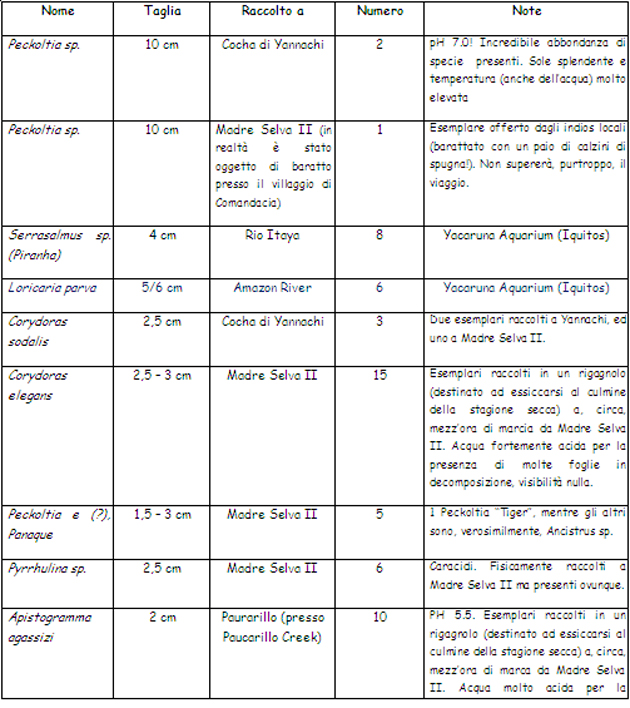
31.07.00: Inizia la prima giornata sul Rio Orosa. La notte appena trascorsa con il “night float” (risalita del fiume con una piccola lancia a motore e, successiva, discesa a corrente) è stata indimenticabile: ho catturato il mio primo – e vero – loricaride selvatico, di cui, successivamente, cercherò di dire genere e specie. L’alba è splendida, solamente macchiata da qualche nube: la mia prima alba amazzonica. E’ piacevole poco alla volta apprendere, almeno i più semplici, segreti del bosco: fila di piccole bollicine di aria che emergono dall’acqua scura? Tartaruga che nuota sott’acqua; poi, di notte (se illuminati dalla lampada) punti verdi che luccicano? Gli occhi di un ragno (ci sono esemplari notevoli), punti rossi? Gli occhi di un caimano e così via … La tentata cattura di un piccolo esemplare di caimano, ad uso fotografico, non ha dato esiti positivi. Tutto intorno è buio, silenzio, stelle lucenti e gridi misteriosi. Se soltanto potessi fermare il tempo. Oggi giornata epica: “acchiappanze” multiple, ed alcune notevoli, alla Cocha (laguna) di Yannachi, che fa parte del sistema fluviale del Rio Orosa.
Questa foto, un po’ ingiallita dal tempo, racconta della “epica” raccolta alla Cocha di Yannachi: al centro, con il cappello giallo, ci sono io alle mie spalle “Senor Insecto”, sulla destra “Professor Dick” che, durante tutte le operazioni sul campo, si occupò di aggiornare il log dei pesci rinvenuti. Infine in acqua – impegnati nel lavoro “sporco” – ci sono Cesar e Segundo.
Altra foto nello stesso luogo, mentre io “cerco” nella rete “Jungle Jim” (dietro, col cappellaccio) si occupa del cambio d’acqua ai contenitori da trasporto.
Probabilmente era salito a bordo in cerca di cibo (la nostra cambusa non era precisamente del tipo a … “chiusura controllata”), aprendo la porta al’improvviso lo abbiamo sorpreso allo scoperto: la sua reazione (foto) è stata abbastanza indispettita …
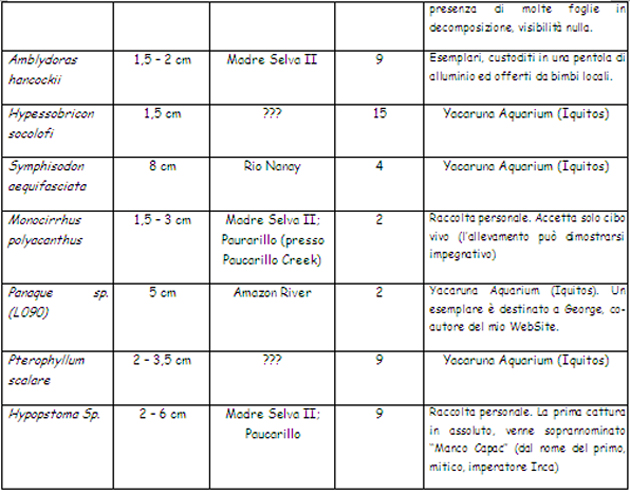
La prossima volta che un piccolo, grazioso, loricaride attira la vostra attenzione nel fare l’analisi dello spazio che potete dedicargli in vasca rammentatevi di questa foto … 01.08.00: Stanotte incredibile marcia notturna nella giungla (peccato che la videocamera abbia fatto cilecca: batterie KO, ma forse è stata colpa dell’umidità!): insetti vari, bellissime tarantole (credo), tra cui una rossastra che i locali chiamano “Pinto”, un bradipo che, con fortuna, ho notato mentre si muoveva lentissimo tra le cime degli alberi, rane, serpenti. Punti negativi: caldo, umido, mosquitos, mosquitos, mosquitos … Infine oggi andremo a Paucarillo Creek: avamposto estremo di “Project Amazonas” e da li, fatalmente, inizieremo a ripiegare verso Roma (e verso la fine del nostro sogno). Infine eccoci arrivati: ignoro se (Paucarillo Creek) significhi “il posto delle farfalle” ma ne è pieno, e sono di tutti i colori. Siamo a tre ulteriori ore di navigazione da Madre Selva II (ci troviamo, quindi, oltre 100 km all’interno della foresta, rispetto ad Iquitos). Le facce dei locali sono molto più “indie”. Il posto è incredibile, ancora una volta, allarga il cuore e lo riempie di pace, e per un ““irrequieto” come me è tutto dire …
Il campo di Paucarillo Creek, cosi come appare arrivando dal fiume. Nella grande capanna centrale avranno luogo, praticamente, tutte le nostre attività. Il complesso è su palafitte per evitare che nella stagione delle piogge vada “sotto” ed anche, forse, per evitare (nottetempo) le visite più moleste …
Il silenzio che ci circonda è, quasi, assoluto. Nel pomeriggio altro “jungle trail” lungo ed impegnativo, in ragione del clima e della morfologia del terreno: grossi alberi caduti, fango, calore, umidità … nel corso della marcia abbiamo identificato alcune pozze popolate di Killy-fish rinvenendo, però, solo femmine (identificate come Rivulus sp.): non essendo di nostro interesse le abbiamo rilasciate immediatamente.
02.08.00: Comincia un altro giorno in pace e nel silenzio. Nella notte disperata, e perdente, battaglia con le innumeri zanzare filtrate, non so come, oltre le zanzariere. La situazione si è fatta tale da essere svegliati, una volta svanito il repellente con cui ci siamo “aspersi” prima di andare dormire, dai pizzichi (!) vedendoci costretti a ripetere l’operazione e poi, in seguito, essere nuovamente costretti alla medesima la procedura! Oggi pare prevista una intensa giornata di raccolta. 0re 12.00 acquazzone verace, sul ritorno da Paucarillo Creek un ruscello – che da il nome al secondo campo – letteralmente pullulante di Apistogramma e caracidi di tutte le specie. Peccato che non sia ciò che cerco … Per dire, fermo restando che non ho voglia di tornare, la verità vera: comincio ad “accusare”, sono in riserva. Speriamo – nel mentre – che spiova, non abbiamo più molto tempo. Però, in fondo, per capire un luogo fatto anche di piogge forti serve anche … una pioggia forte! Quindi ben venga la pioggia … Spero, da ultimo, che stanotte si possa fare il, previsto “night float”; sino ad ora è l’esperienza che mi è piaciuta di più! Riflessioni al tramonto: questa giornata che doveva essere piena di pesci e di catture (manca, è vero, ancora l’uscita notturna) si è rivelata piena di delusioni! Dopo una giornata a sbattersi tutto ciò che abbiamo raccolto sono un po’ di caracidi ed Apistogramma ed 1 (uno!) pesce foglia (Monocirrhus polyacanthus). Non si tratta solo di sfortuna, per le mie cognizioni, la giornata di raccolta odierna è stata gestita … a coda! Sono; diciamo così deluso. 03.08.00: Si va via! I risultati della pesca di ieri, già modesti, sono, nella notte, stai depauperati ulteriormente da un numero di “suicidi”, ovvero pesci saltati dai contenitori di stabulazione, insolitamente alto. Vuol dire che deve andare così …. Siamo sulla via di Iquitos, verso fine dei giochi: dopo una fruttuosa, acchiappanza di Corydoras (quasi tutti Corydoras elegans), dopo un pranzo (ancora) a Madre Selva II, dopo un giro in kayak, dopo la sosta al villaggio indio (per il baratto), dopo l’impacchettamento dei pesci … dopo tutto ciò: FINE! Del baratto con i nativi: in Amazzonia la prassi di scambiarsi oggetti di necessità in un ambiente in cui la moneta ha un valore relativo è ancora assolutamente in voga. Arrivati al villaggio (nativi di etnia Yagua) ha luogo la richiesta, al capo villaggio, di poter entrare nel villaggio e dare il via agli scambi (forse è un proforma, ne convengo, ma le usanze vanno rispettate), mentre noi sbarchiamo i nativi tutti (uomini, donne e bambini) espongono, in silenzio, la loro mercanzia ed aspettano: effettuata la scelta si ha, in risposta, la richiesta. C’è margine, per una modesta, trattativa. Raggiunto l’accordo lo scambio ha luogo ed i due “oggetti” cambiano padrone con un sorriso ed una stretta di mano. Sulle prime si resta un poco sconcertati dall’idea di barattare abiti usati con oggetti di artigianato (talvolta, detto per inciso, di fattura modesta) e si è indotti a pensare ad una forma di “donazione” sotto mentite spoglie.
A tal proposito l’intervento della guida serve a chiarire le idee spiegando il punto di vista dei nativi: essi hanno bisogno del baratto per procacciarsi oggetti altrimenti difficilmente disponibili e, dal loro punto di vista, lo considerano vantaggioso perché ricevono, da noi, materiale per procacciarci il quale siamo “costretti” ad andare in città e a lavorare. Mentre loro danno in cambio manufatti realizzati con materiali (legno, ossa, semi, fibre vegetali) che la foresta generosamente fornisce, basta camminare e raccoglierli. Dal loro punto di vista la convenienza è assicurata e lo scambio avviene con reciproca soddisfazione: sta a noi, ovviamente, non esagerare nel fornire “stracci”. Per chiarire il concetto ho barattato una bella Pekoltia (un loricaride) di una dozzina di cm con un paio di tubolari (calzini) di spugna. A scambio avvenuto entrambi (io ed il nativo) sorridevamo sotto i baffi convinti di aver “fregato” la controparte … Stefania, a sua volta, ha scambiato quattro collane per una polo e, ancora, due paia di calzini. Re, indiscusso, di questa attività è stato uno degli americani “Barter Bob” (Bob il barattatore, appunto!) che ha scambiato martelli con cerbottane, magliette con cesti di fibra di palme, fili ed ami da pesca (molto richiesti per ovvi motivi) con piccole sculture in legno poi ancora caramelle con collanine e chi più ne ha più ne metta … finito il negozio grandi sorrisi sanciscono la reciproca soddisfazione e si ritorna alla barca, accompagnati dalle grida eccitate dei bambini, per l’ultima notte di navigazione che avrà termine ad Iquitos. Da qui in poi saranno: pazienti attese (20 ore di barca per risalire il Rio Amazonas sino ad Iquitos), burocrazia, preoccupazioni per i pesci, dogane, voli e fusi orari. Infine, finito il bailamme, sarà il tempo dei ricordi (e del rimpianto) … la “giostra” continua. Come sempre nulla è finito fino a che non è REALMENTE finito; dopo tutto quanto sopra (oggi come nei giorni precedenti) il fiume, generoso, ci regala la magia dell’incontro con gli sfuggenti delfini rosa, tipici del Rio delle Amazzoni. 05.08.00 (Iquitos): Sotto una pioggerellina “simil-inglese” ci prepariamo ad andare. Le preoccupazioni finali sono, come sempre, per i pesci. Stanno bene? Ce la faranno? Abbiamo tutti i documenti per la spedizione? Ancora una volta è la solita routine, a valle della quale ci aspetta la nostra vita di sempre. E’ stato incredibile. E’ finita, peccato! A testimonianza della eccezionale abbondanza di vita (acquatica ma non solo) riporto l’elenco (di parte) delle specie inventariate durante la nostra permanenza in foresta.
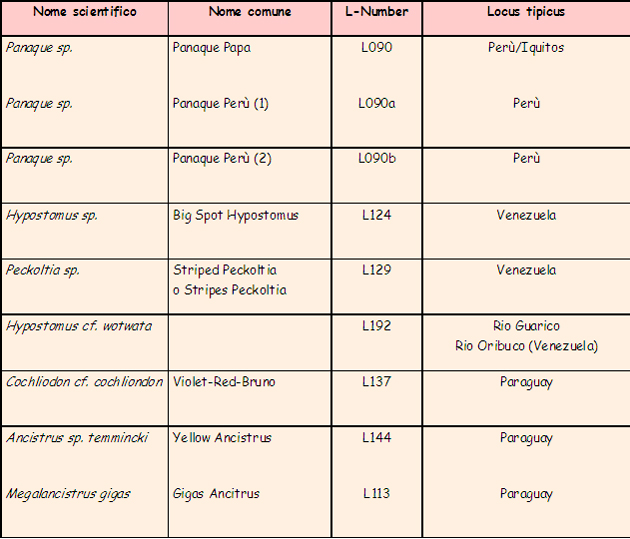
Vanno inoltre, almeno, menzionati: esemplari di Crenicichla sp.; Satanoperca jurupari, Aequidens sp. (A. pallidus, A. thayeri ed altri), Piranha (principalmente “bianchi” e, in numero minore, “rossi”), un numero sconfinato di caracidi, “pesci gatto” di tutte le taglie come Pimelelodella sp, Pseudoplatistoma fasciatus, Sorubim lima, Rineloricaria sp, alcuni gamberi a me sconosciuti, rane del genere Pipa (Pipa sp.) ed altro ancora. Yacaruna Aquarium (di Iquitos) è un esportatore – allora molto attivo – di pesci cui ci siamo rivolti per le pratiche di esportazione, l’accordo è che le medesima siano svolte gratuitamente in cambio di acquisto di (un certo numero di) esemplari che loro hanno in disponibilità. Le sagge leggi locali (di allora) autorizza(va)no l’esportazione di un “box” (per ogni partecipante al viaggio) a titolo di hobby, per quantitativi maggiori occorre(va) intraprendere – in proprio – la lunga e complessa procedura di export a titolo commerciale/professionale. Viene ovviamente richiesto (i controlli in aeroporto sono/erano ferrei, come da esperienza personale) di limitarsi ai generi/specie il cui export è consentito (in pratica i soli pesci: niente rettili, anfibi, insetti, uccelli). Va aggiunto che una esportazione così regolamentata, ed effettuata “alla luce del sole”, consente di mettere i propri soggetti nelle condizioni di affrontare il viaggio al meglio, con evidenti vantaggi in termini di resa (significando con tale affermazione che la inevitabile percentuale di perdite durante il viaggio risulta modesta). Funziona … e funziona molto bene, lo posso assicurare!!! • I loricaridi, in natura: le specie ed i biotopi “NON amazzonici” In queste mie considerazioni faccio riferimento – quasi sempre – all’Amazzonia da ritenersi come il biotopo principe, pur con infinite sfaccettature, frequentato dai loricaridi. Per completezza di esposizione va però ricordato che i loricaridi popolano anche altri ambienti che vanno dalle “terre alte”, così avremo un Ancistrus che si muove nelle acque del Rio Urubamba (in Perù, e siamo a 2.000 mt s.l.m.) che scorre, tumultuosamente, lungo la valle sacra che porta alla “città perduta” di Macchu Picchu e altri che nuotano nelle “terre fredde” (intendendo come tali quelle a sud del Brasile) come Uruguay,ed Argentina (tra gli altri) anche a latitudini sorprendentemente avanzate. Un amico che ha più volte viaggiato in Uruguay mi ha parlato di (riferendosi ad Ancistrus sp.): “… almeno 2 specie ancora da descrivere …” riportando di averle incontrate in ambienti (fatti di sassi e forti correnti) che ha paragonato ad un nostro ruscello montano. A titolo di curiosità posso aggiungere che una moltitudine di loricaridi (solo parzialmente alieni, vista la loro origine) vive, beata e tranquilla, negli specchi d’acqua metropolitani e nelle fontane di Rio de Janeiro (ad esempio al Giardim Botanico e nella, già citata, Floresta da Tijuca), un po’ come da noi i pesci rossi. Si tratta – ad un osservazione senza poterli estrarre dall’acqua – di esemplari ascrivibili ai generi Hypostomus, Liposarcus e – probabilmente – Glyptopetichthys. Questi pesci sono, in Sud America, praticamente ovunque. La tabella che segue – oltre a darne un esempio – introduce inoltre alcuni elementi di terminologia tipici dell’ambiente dei loricaridi con i quali è bene cominciare a familiarizzare perché, per chi si appassionerà davvero a questi pesci, diverranno una sorta di “pane quotidiano”. Mi riferisco ai titoli delle colonne due, tre e quattro:
Le indicazioni in tabella sono largamente incomplete (vengono richiesti dati più completi del mero nome del fiume/areale di rinvenimento arrivando – ai nostri giorni e nei casi ottimali – sino all’indicazione delle coordinate GPS) ma mostrano comunque come la zona di distribuzione – di determinati generi – possa travalicare i confini della pur sconfinata Amazzonia o – in altri casi – non toccare neppure l’area.
Sono evidenziati alcuni degli areali (di pertinenza dei loricaridi) di acque comunque, “calde” (come quelle del Venezuela) e, al contrario, “fredde” (Perù e Paraguay). Nel primo caso per motivi di altitudine (è sulle Ande peruviane che nasce il “Grande Fiume”), nel secondo per motivi geografici: il Paraguay situato a sud dell’immenso Brasile si trova a latitudini soggette a periodi freddi. • Le acque in cui si muovono in natura i loricaridi Le acque dell’Amazzonia e gli ambienti che esse formano possono, in relazione al biotopo di riferimento principale, essere catalogate come:
Muoversi – in cerca di pesci da acquario – nelle acque amazzoniche significa operare (più o meno immersi, è successo anche a me) in acque che ospitano soggetti come da foto, e non solo. Osservare suggerimenti e disposizioni dei locali, sul come comportarsi in simili situazioni, è fondamentale. In funzione della loro origine (parlo non specificamente del Rio Amazonas) e composizione le acque dei principali corsi d’acqua del bacino possono, sinteticamente, essere divise in “bianche”, “chiare” e “scure” tale divisione si riflette sui rispettivi ambienti fluviali.
• I loricaridi, in natura: brevi note di tassonomia La classificazione tassonomica – nei suoi fondamentali che sono sufficienti al nostro scopo – recita (ad esempio per Ancistrus ranunculus):
Credo sia sufficiente e che valga la pena di focalizzarsi, un po’ più in dettaglio, sulle peculiarità biologiche di questi pesci.
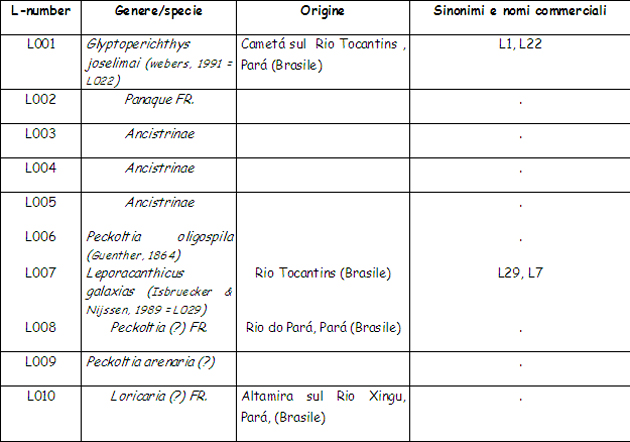
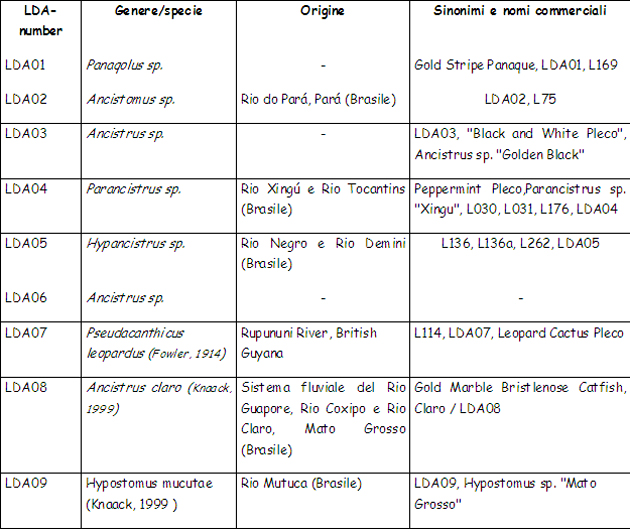
• I loricaridi, in natura: gli “L-number” e gli “LDA-number” (come funzionano, a che servono) La classificazione tassonomica di questi pesci (intendo del singolo genere/specie) è, al minimo, caotica e presenta – se/quando disponibili – una congerie di nomi scientifici, talvolta dubbi, di sinonimi, di nomi “comuni” e/o commerciali (questi ultimi discendono da una abitudine tipicamente USA, dove questi pesci sono molto popolari). Alla situazione, aggravata dalla continua scoperta di nuovi generi e specie, si è cercato di porre rimedio mediante l’uso degli “L-Number” (L = Loricaridae) mediante i quali si cerca di attribuire a tutti i rinvenimenti una identificazione univoca (almeno numerica) in attesa di una successiva classificazione/revisione , che risulti quanto più è possibile esaustiva. L’intento – ovvero l’utilizzo degli L-Number – è assolutamente lodevole, ma nella pratica vanificato dall’esistenza di differenti sigle/numerazioni di classificazione (es.: “L” ed “LDA”) con numeri “ovviamente” … NON coincidenti! Di seguito un breve paragone (elenco da 1 a 10) dalle liste “L-number” ed “LDA-number”. I dati pur non aggiornatissimi non credo necessitino di ulteriori commenti. Mi limito ad aggiungere che i miei Hypancistrus, di cui successivamente racconterò l’allevamento e la riproduzione, hanno, in base alla prima numerazione loro imposta, un L-number pari 333 (e sono noti ormai da alcuni anni): il loro nome “in codice” è infatti Hypancistrus sp. L333, e le scoperte di esemplari in attesa di classificazione continuano … Anche il più solerte dei tassonomisti si trova di fronte ad un compito che se non è impossibile (nihil difficile volens) è almeno, per usare un eufemismo, estremamente impegnativo.
Di seguito, invece, i primi 10 LDa-number
• I loricaridi, in natura: influenza della stagionalità sulla biologia dei loricaridi Abbiamo visto precedentemente quali siano le ciclicità climatiche proprie dell’ambiente amazzonico ed i loro riflessi sulla biologia dei loricaridi. Da quanto precedentemente esposto dovrebbe essere chiara la marcata “dicotomia stagionale” che consta di una stagione calda e secca (che spesso si spinge ai limiti estremi con tutte le conseguenze del caso) ed una stagione piovosa più fresca (in cui tutto l’ecosistema si “ricarica” preparandosi alla nuova sfida che, immancabile, arriverà …). Vediamo quindi cosa si può fare per invogliare i nostri “gatta pesci” alla riproduzione ripercorrendo i passi visti prima e proponendo (quando possibile) una – o più – opzioni per replicarli.
Alcuni dei parametri/cambiamenti appena visti sono facilmente riproducibili in acquario, altri un po’ meno altri – infine – per nulla, o quasi … Ma vanno, comunque, tenuti in considerazione: molte specie di loricaridi sono guidate, nell’attività riproduttiva, da una serie di eventi meteorologici assimilabile a quanto, per sommi capi, sopra descritto. Alcuni di loro mantengono tale stagionalità anche in vasca e anche dopo molti anni – e riproduzioni – in cattività. Questo stato di cose comporta, come conseguenza, la “variabilità” dei successi riproduttivi degli allevatori di loricaridi: con questi pesci, a differenza di altri, (ad esempio molti dei ciclidi), non basta fornire loro una vasca correttamente gestita e la giusta “sex-ratio” per arrivare al successo. Spesso vi si arriva per approssimazioni successive, per reiterati tentativi, per “dritte” ricevute (fondamentale nel caso dei miei L333!) ed anche per un po’ di quella fortuna che, da sempre, soprassiede alle umane vicende. Riuscire in una riproduzione di questo tipo però procura – lo posso garantire – una soddisfazione incredibile: il livello di “approssimazione al vero” che si è riusciti a raggiungere è elevato e questo gratifica. • I loricaridi in acquario, la vasca ed il suo set-up Cominciamo col dire che per questi pesci NON esiste una vasca tipo (almeno per come sono usi considerarla gli appassionati di ciclidi). Troppo diverse sono le esigenze delle differenti specie: è, al massimo, possibile individuare le esigenze di un genere/specie o ancora (e meglio) di pesci provenienti da un determinato e ristretto areale, se/quando noto. Detto che sono, per la più parte, sciafili a seconda delle specie che alleveremo ci confronteremo con pesci di acque fredde (es. gli esemplari delle zone andine in Perù, ma non solo) o al contrario molto calde (medio/basso areale amazzonico dove – in alcuni casi – si registrano temperature stabilmente oltre i 28° C), con specie provenienti da acque con forte corrente ed elevato tenore di ossigeno o, al contrario, quasi stagnati ed al limite dell’anossia, ed ancora con valori chimici che spaziano tra il marcatamente alcalino (contrariamente alle credenze comuni) ed il decisamente acido: in breve? Tutto ed il suo contrario ed una paziente opera, preventiva, di raccolta di informazioni sulle effettive necessità della specie che intendiamo allevare è – mai come in questo caso – un obbligo assoluto. Concentriamoci ora sui fondamentali della vasca per i loricaridi.
• I loricaridi in acquario: il loro allevamento, l’alimentazione e la gestione della territorialità ed aggressività Questi pesci sono meravigliosi e molto interessanti da allevare, a patto che vengano rispettate le loro esigenze basilari (in certi casi NON sono poche, e nemmeno semplici): Sono pesci, sostanzialmente onnivori, ma dalle esigenze trofiche più disparate: carnivori, fitofagi, (ma anche xilofagi!) … Rispettare le loro esigenze di alimentazione è fondamentale per farli vivere correttamente. In particolare la “legnina” è fondamentale per la corretta funzionalità digestiva di molti di essi. Ci deve, quindi, essere SEMPRE almeno un “legno” in vasca. Offriremo loro cibo in compresse/tavolette, pesce in piccoli pezzi, verdure cotte e crude, alimenti surgelati e quanto di altro (alcune specie gradiscono la frutta: i miei Hypostomus apprezzavano il melone) la nostra fantasia ci suggerirà.
Ricordiamo che sono abituati a nutrirsi al fondo (e di notte): evitiamo la convivenza con pesci troppo vivaci e somministriamo il cibo, a loro destinato, con le luci spente o immediatamente prima del loro spegnimento. Sanno, e ve lo dimostreranno se necessario, arrivare al cibo ma non bisognerebbe snaturare eccessivamente i loro comportamenti. La territorialità e l’aggressività dei loricaridi (meglio di determinate specie) arriva a livelli tali da far impallidire i ciclidi più riottosi. Anche un “banale” Ancistrus mal tollererà un altro maschio troppo invasivo nel suo territorio, dovremo quindi dimensionare le vasche di conseguenza e predisporre – in questo l’esperienza ciclidofila può essere di aiuto – apposite barriere visive atte a “spezzare” l’ambiente ed rendere disponibili un numero di rifugi che sia superiore (per almeno una unità) al numero di esemplari che alleveremo. Avere sottostimato questo aspetto temperamentale mi costò, anni addietro, la perdita di tre Hypancistrus zebra (L046). Prestate, quindi, attenzione … • I loricaridi in acquario, preparazione di un estratto di “black water” Una volta rientrato dall’Amazzonia mi sono trovato (da buon appassionato di ciclidi africani è stata la prima volta) a dover gestire pesci provenienti da acque caratterizzate da reazioni chimiche sostanzialmente differenti da quelle cui ero abituato (sul campo ho – deliberatamente – scelto specie dalle esigenze non troppo estreme, insomma i Discus non erano per me). Il primo, ovvio, passo è stato quello di utilizzare – per ottenere l’acqua “giusta” – prodotti commerciali (di marca), che risultarono graditissimi ai pesci ma molto meno al mio portafoglio! Cominciai quindi a ragionare sul perchè le acque acide dell’Amazzonia (spesso dette “cola water” in ragione del colore) avessero proprio “quella” chimica specifica. Realizzai così che, oltre la pioggia, c’erano anche altri input quali foglie cadute dalla volta della foresta sottostante oltre a rami, frutti e semi (della medesima origine). L’elemento che mi diede la spinta definitiva fu l’etichetta (che ritenni affidabile) su una confezione vista in vendita da un famoso specialista belga di pesci amazzonici, che ebbi modo di visitare in occasione di un meeting MCH. Tale etichetta recitava (semplicemente e testualmente): Foglie raccolte nella foresta amazzonica. Ogni confezione conteneva dieci (!) foglie e non era economica … PREMESSA: procacciarsi quindici grosse, ben secche, foglie di quercia essendo assolutamente sicuri che le stesse siano “pulite”, il che vuol dire: niente uova/larve di insetti e/o esposizione a pesticidi di alcun tipo od altri inquinanti! Nel dubbio non usatele … a questo punto:
Come considerazioni finali posso aggiungere: 1. Aggiungere una bella radice (personalmente preferisco la “torba” al “mopani” anche per ragioni estetiche) aiuta non poco. Il rilascio di sostanze nell’acqua, consistente all’inizio, calerà nel tempo anche se il degrado sarà lento, Mi sembra superfluo aggiungere che se, da una parte, i miei pesci hanno apprezzato (ad oggi, 2012, ho ancora un loricaride preveniente da quel viaggio – svoltosi nell’anno 2000 – che nuota in vasca) dall’altra il titolare del negozio in cui mi servo (mio buon amico) lo è stato un po’ meno!!! Ma ripeto che con 500 litri (e più nel seguito) di acqua da gestire la ricerca di una alternative è stata – come dire – una soluzione obbligata! • I loricaridi in acquario, la riproduzione Sin qui la teoria, ma … in vasca che accade DAVVERO? Vediamolo brevemente, con riferimento a due differenti generi di loricaridi, e segnatamente:
• I loricaridi in acquario, la riproduzione di Ancistrus sp. Ancistrus sp. – oltre ad essere il tipo più diffuso in acquario è (come suggerisce, o dovrebbe suggerire, il nome) un ibrido, più o meno volontario, di differenti specie di pesci, provenienti dagli areali più disparati, e tutti appartenenti in natura al genere Ancistrus. È un pesce “commerciale” (per convenzione sp. III indica le forme “brown” o simil-selvatiche mentre sp. IV indica quelle albine/amelaniche) che tramite una rozza, ma efficace, opera di selezione dell’uomo ha sviluppato una elevata rusticità che lo porta ad adattarsi a situazioni che sono, sovente, completamente agli antipodi di quanto accade in natura. Ho visto Ancistrus riprodurre (senza apparenti difficoltà) in una vasca di Frontosa, ho avuto l’esperienza di una deposizione in condominio con grossi “calibri” del Centro-America, e di quelli turbolenti! Praticamente nulla o quasi di quanto visto in precedenza si attaglia agli Ancistrus, diciamo che fra i loricaridi della selva amazzonica sono quelli più accomodanti, senza però che questo si debba leggere come una autorizzazione a … “fare di tutto”. Almeno una cosa però – nella mia esperienza – la ho imparata: una vasca (di dimensioni dignitose) se non “dedicata” almeno molto tranquilla, come dire? Non basta … ma aiuta! Osservare il loro comportamento riproduttivo suggerisce – poi – alcun e interessanti osservazioni. Un traccia della stagionalità riproduttiva si rinviene nello stimolo alla deposizione che arriva da uno, o più, cambi d’acqua ravvicinati, massivi e con acqua più fresca. Sinceramente non mi sono mai peritato (vedi sopra) di andare a verificare le previsioni sulle variazioni di pressione attendendo una (magari repentina) marcata caduta di pressione che i pesci potessero leggere come … burrasca, ma ho usato, spesso, il trucco dello “shock termico in caduta”, e con successo! Altro stimolo che è conveniente introdurre è la variazione del regime alimentare, che cambierà in offerta ed aumenterà in disponibilità. Qualcosa di più nutriente, senza esagerare visto che siamo sempre di fronte ad erbivori/alghivori, darà intraprendenza ai maschi e, nelle femmine, potrà fungere da stimolo all’ovulazione che è poi – nell’ipotesi di non usare, come io sono solito fare, alcun tipo di ormoni – il punto chiave della faccenda. A titolo di osservazione personale posso aggiungere che la principale difficoltà – nella riproduzione di Ancistrus sp. – consiste (o può consistere) nel far raggiungere alla femmina la prima ovulazione. Ottenuto questo (a noi) invisibile – ma fondamentale – risultato gli Ancistrus faranno, in pratica, tutto da soli. Spesso, giunti a questo punto, il problema sarà … FERMARLI!!! Sempre al ricordo ancestrale della “stagionalità” riporta – a mio modo di vedere – il concentrasi di più deposizioni ravvicinate in un periodo temporale relativamente breve, seguito quindi da periodi di riposo/stasi (se si riesce a comprendere tale alternanza può essere una buona idea cercare di uniformare gli interventi manutentivi della vasca allo stesso ritmo). Sovente un maschio (colui che accudisce le uova) in presenza di più femmine si prenderà cura di più gruppi di uova rilasciate, dalle donzelle di passaggio, in tempi ravvicinati (ma non coincidenti). Se si verifica un evento del genere preparatevi – alla fine della cova – ad un’autentica invasione di “baby-ancistrus” che, sciamando in ondate successive dal loro rifugio, finiranno ovunque (sovente anche dove non dovrebbero, come nella scatola del filtro): schermate bene tutti i passaggi! Fondamentale è la disponibilità di un rifugio scuro, stretto e di accesso non troppo agevole al cui interno il maschio – caratteristica peculiare di tutti i loricaridi – accudirà nell’ordine uova, larve ed avannotti sino a che questi ultimi non saranno sufficientemente sviluppati da saper badare a se stessi.
Girando, con circospezione, l’anfora (per renderne visibile l’interno) si notano le pinne del maschio intento a ventilare e parte degli avannotti, ormai formati, che attendono di uscire per curiosare in vasca … Più sopra parlavo della sostanziale indifferenza dei loricaridi all’arredo vasca, bene il sito di riproduzione di molti loricaridi ne è la trova tangibile: i miei Ancistrus – dopo che ho offerto loro di tutto – hanno scelto, e mai più abbandonato, una tristissima, piccola, anfora in terracotta di quelle che si usa(va)no per nascondere la pietra porosa necessaria per avere l’effetto bollicine … altro che sofisticate tecniche di acquascaping e/o scelta di materiali simili a quanto disponibile in natura: un banale “mattoncino”, ed anche di quelli di terza scelta … che ammetto di aver offerto loro, dopo aver provato di tutto, senza neppur troppa convinzione. Ed invece …
Il maschio, che come detto cura uova, larve ed avannotti, a difesa della piccola anfora di coccio. Attorno a lui si notano avannotti di differenti covate (tre), e conseguente differente taglia. Concludo con una curiosità, si ritiene che i “bargigli” dei maschi – che estratti dall’acqua si afflosciano mestamente – hanno sul muso vengano letti dalle femmine, nelle scure acque originali, come uova già in cura, il che dimostrerà loro che si tratta del cosiddetto “partito sicuro” (da leggere come un maschio in grado di dare – accudendo bene le preziose uova – continuità alla specie), per tale ragione maschi “baffuti” saranno, generalmente, preferiti ad altri dal crine più corto. It’s the Amazon fashion …
• I loricaridi in acquario, la riproduzione di Hypancistrus sp. L333 Hypancistrus sp. L333: per riuscire nella loro riproduzione occorre un approccio un po’ più “pensato”, più vicino alle considerazioni svolte in merito a quanto accade in Natura e – ultimo ma non ultimo – un po’ più … spigliato.
Giovanile di Hypancistrus sp. L333, ritratto immediatamente dopo il suo arrivo in vasca.
Sin qui (sopra) nulla di trascendentale infatti è solo a questo punto che inizia la “preparazione specialistica”, infatti offriremo loro:
Si ripropone, anche qui, il completo menefreghismo per l’arredo e per la foggia dei siti di riproduzione: sono giunto ad usare, dopo alcuni tentativi, pezzi di “foratino” (mattoni da edilizia) tagliati e sagomanti alla bisogna oltre che – ed è importantissimo – chiusi in maniera maniacale su un lato. Quello che si definisce un “cul de sac” che però essendo risultato gradito diede vita col crescere della taglia a ripetute scaramucce per aggiudicarsi uno di tali rifugi. Ho iniziato con due “tane” (appunto di foratino) cui ho poi aggiunto, in seguito, due altre tane (specifiche per loricaridi e ben più gradevoli all’aspetto) comprate all’Acqua Beach di Cesena: saranno più belle ma la fungibilità è pari, assolutamente, a quella del foratino. I maschi che sono riusciti ad aggiudicarsi un territorio non sembrano fare, almeno alla mia osservazione, differenze in merito.
Una delle tane (da me approntate) posizionata in vasca. Devo ancora comprendere che le Ampullaria (a Sx) e le Vallisneria (a Dx si vedono le radici) sono “scarsamente compatibili” con gli L333.
Maschio che ha preso possesso della “buca”: da questo momento in poi, facendo i debiti riti propiziatori, occorre solo attendere che Madre Natura faccia il suo corso. Tutto quanto in nostro potere è stato esperito, occorre solo aspettare. La fase riproduttiva vera e propria – posto che sia stato rispettato quanto sopra – è abbastanza caratteristica ma poco vistosa: ogni maschio titolare di una buca resta infilato (con la coda sventolante che sporge fuori) ed attende … Le femmine, molto più schive, girano per la vasca liberamente e quando sono pronte alla deposizione si avvicinano alle tane. Il segnale è il loro soggiornare sopra/di fianco alle “piazzole” gestite dai maschi (è possibile che nella fase di approccio cambino cavaliere, come che più femmine puntino lo stesso luogo), sembrano osservare ed attendere di essere pronte. Il passo successivo, con l’ovulazione al culmine e la conseguente necessità di deporre, vede la femmina cercare di entrare nella tana attività in cui (viste foggia e dimensioni) non riuscirà del tutto, o lo farà con molta difficoltà: in tal modo segnala al maschio che ha necessità di “scaricarsi”.
Due “tane” (entrambe in foratino) affiancate, osservandole si nota come quella sinistra ospiti DUE pesci (ovvero è in atto una deposizione), mentre a destra (nella tana più scura) il maschio deve fare esercizio di pazienza. Questi allora lascia spazio, eventualmente uscendo brevemente dalla buca, e la femmina si libera del suo prezioso carico (allontanandosi successivamente). Il maschio a questo punto – avendo fertilizzato le uova – le accudisce sventolandole di continuo; proseguirà tale attività per tutta la durata dello svezzamento (che si conclude con il completo riassorbimento del sacco vitellino) al termine del quale i nuovi nati, minuscoli ma completamente formati, usciranno dalla buca paterna ed andranno incontro al loro destino. Di nuovo la forte corrente viene in aiuto tanto al genitore che ai nuovi nati trasportando, nelle diverse buche, il cibo che offriremo loro (ed avremo cura di rendere tale trasporto il più agevole possibile). Segnalo che il numero di uova deposto non è mai molto elevato (e questo da, come conseguenza, cure parentali più accurate). Anche i questo caso (ma trattandosi di esemplari F1 è più comprensibile) si evidenziano elementi, e comportamenti, che rammentano ciò che accade nella selva, a titolo di esempio cito la, in pratica, contemporaneità delle riproduzioni/deposizioni (ho, come detto, quattro siti di deposizione) che lascia pensare che i pesci (tutti) interpretino ciò che accade in vasca come un momento favorevole, cui va aggiunto – e succede per molti altri animali in natura – che la sincronia nelle nascite, con un elevato numero di nuovi arrivi in tempi ridottissimi, aumenta sensibilmente le possibilità di sopravvivenza di ogni esemplare. Loro non sanno che in vasca non ci sono predatori, ed il cibo è abbondante a prescindere, ma fa lo stesso …
La vasca, qui ripresa al momento della somministrazione del cibo, è sostanzialmente più “vissuta” (rispetto all’immagine proposta all’inizio) e sta – pian piano – diventando il “loro” ambiente …
Sempre in base a suggerimenti ricevuto ho preso quindi l’abitudine (ogni tre/quattro mesi meglio se in una fase in cui le buche di deposizione sono vuote) di svuotare la vasca e, con calma certosina, ispezionare ogni anfratto ed ogni buco alla ricerca dei piccoli: non aspettatevi numeri da ciclidi o da poecilidi, ma se avrete fatto le cose per bene sarete gratificati dalla raccolta di piccoli L333 che sono una “copia in sedicesimo” dei genitori, a questa età/dimensione è impossibile (a me riesce difficile anche dopo, lo ammetto!) “sessarli”: limitatevi – quindi – ad allevarli per quello che, in questa fase, sono; dei piccoli, simpatici … “pupazzetti”! Il vostro obiettivo finale sarà quello ripreso nella foto sotto …
• Bibliografia (minimale): – Loricariide: all L-Numbers Ed. Aqualog Verlag A.C.S. Gmbh, NOTA: (sul libro di Aqualog): è un testo fondamentale dal punto di vista della classificazione/identificazione dei generi/specie è (era) prevista (ma occorre la costanza di seguirla) la pubblicazione periodica di “figurine adesive” (delle nuove specie rinvenute in natura) da incollare su pagine “vuote” predisposte all’uopo dall’editore. Modeste, invece, le altre informazioni fornite che – in caso – andranno cercate su altre fonti. Un testo interessante molto figurato, con una impostazione grafica di qualche anno fa ma che è ancora ragionevolmente attuale anche se la reale fungibilità/semplicità d’uso è, ormai, fortemente incalzata dalla diffusione in rete delle informazioni che contiene. Per coloro che amano “la carta” – come me – è comunque un buon punto di riferimento. NOTA: (sul libro di L. Vires): Questo libro – un po’ datato – a modesta diffusione e sempre su canali “alternativi” ormai esaurito e di cui non sono previste ristampe, è una vera Bibbia del “loricaridofilo”, specie per tutti gli aspetti concernenti la riproduzione. È un libro “strano” (non ha neppure un editore di riferimento, a vederlo sembra più una “dispensa universitaria”), dall’aspetto modesto (impaginazione, rilegatura, tipo di carta, privo di foto e con solo pochi grafici e disegni) ma le informazioni che contiene sono di valore inestimabile e molto difficili da reperire – specie tutte assieme – altrove! Un vero “must have”, se vi capita occasione … • Riferimenti internet (minimali): • www.planetcatfish.com |






















































































































 Il Rio Orosa (ripreso dalla prua del Tucunare) durante la navigazione.
Il Rio Orosa (ripreso dalla prua del Tucunare) durante la navigazione.









 Dessert – apprezzato! – a base di frutta per i miei “Pleco”.
Dessert – apprezzato! – a base di frutta per i miei “Pleco”.
















