Con questo mio breve resoconto, vorrei condividere la mia esperienza di allevamento e riproduzione di Neolamprologus caudopunctatus, un piccolo pesce originario del Lago Tanganica. L’acquario che li ospita (tutt’ora) è una vasca di 100x30x45 cm, avviato nel febbraio 2009. Il filtraggio è affidato ad un filtro esterno (Eheim 2032), l’illuminazione è composta da un singolo neon da 25w (Askoll LifeGlo2 da 6700°K), mentre il riscaldamento da un Hydor da 150w. L’allestimento iniziale ha riguardato un substrato di circa 5-6 cm di sabbia fine color ambra, rocce del medesimo colore ed una manciata di gusci di lumaca.
A suo tempo, la popolazione iniziale comprese un gruppo di Paracyprichromis nigripinnis (1M e 3F), una coppia di Neolamprologus brevis e, appunto, 4 esemplari di Neolamprologus caudopunctatus.
Fin da subito i N. caudopunctatus mi piacquero molto. Sono pesci sempre in movimento ed in continua “parata”, in quanto frequentemente distendono le loro pinne, mostrando tutta la bellezza dei loro colori e sfumature. Il giallo intenso della pinna dorsale, l’iridescenza beige – argento delle loro squame, le stupende sfumature perlacee delle pinne pettorali, il fine merlettato di quelle caudali (da qui lo specifico “caudopunctatus”) e l’azzurro elettrico dei loro occhi. Una peculiarità nel dimorfismo sessuale, incontrata in bibliografia (ma da accertare in maniera univoca) e riscontrata in uno dei miei esemplari (il maschio più grande), è il fatto che il maschio possa presentare il bordo finale della pinna caudale di colore giallo, caratteristica comunque sempre assente nelle femmine. Inoltre, un fenomeno particolarmente interessante riguardo la loro livrea è il cambiamento improvviso di colori e disegni quando si impauriscono, si stressano o semplicemente quando la notte riposano sul fondo.
In tali condizioni infatti, il pesce perde la sua naturale brillantezza madreperlacea, sostituendola con delle bande verticali marroni su fondo crema, più evidenti sulla porzione superiore del corpo. I N. caudopunctatus amano decisamente la sabbia. Ci giocano, ci scavano dentro, la setacciano in cerca di cibo e la spostano in continuazione. All’inizio non riuscivo bene a capire se preferivano come rifugio e sito di deposizione gli anfratti rocciosi o le conchiglie.
Così decisi di togliere dalla vasca il secondo maschio. Veramente tentai a quel punto di togliere anche la seconda femmina, ma l’operazione risultò alquanto proibitiva (mi scomparve letteralmente tra le rocce), così la lasciai. La coppia in tal modo divenne più tranquilla, ma non ne voleva sapere di “mettere su famiglia”. Allora decisi di modificare un pochino l’allestimento. Introdussi ancora più sabbia e misi sotto a questa un tubo in PVC ed un paio di vasetti in terracotta (al centro e a destra della vasca). I tre oggetti erano tutti diversi per dimensioni (lungo e stretto, lungo e più largo, corto e largo), così da ampliare le possibilità di scelta. La coppia esplorò le tre tane e poi decise di stabilirsi nel tubo di PVC. Però c’era ancora un problema: il maschio di P. nigripinnis che nuotava continuamente sopra la loro tana, li innervosiva parecchio. Tutto il loro tempo infatti, lo passavano a spostarsi da una tana all’altra (ossia dal tubo in PVC al vaso grande in terracotta, al centro), rimestando continuamente la sabbia ed aprendo e chiudendo alternativamente l’entrata delle tane. La cosa era anche amplificata dal fatto che il P. nigripinnis era a sua volta in riproduzione (la 2°), con 2 delle 3 femmine già in incubazione orale. Decisi così di modificare ulteriormente il layout della vasca, inserendo un lastrone di roccia orizzontalmente e sopra le tane dei N. caudopunctatus. E qui, finalmente, avvenne la svolta. La lastra permetteva una separazione verticale degli spazi in acqua: sopra i P. nigripinnis e sotto i N. caudopunctatus. E mi accorsi da subito che la coppia (maschio e femmina alfa) iniziò con più convinzione a darsi da fare intorno ad una tana (il tubo in PVC). Notai anche una foga decisamente maggiore del maschio nel cercare di convincere la femmina alfa ad entrare e rimanere nella tana. Non erano infrequenti infatti, poderosi “morsi” e risolute spinte del maschio sul fianco della femmina, seguiti da dense e fulminee nuvole di sabbia alzate per la lotta. Il tutto, comunque, senza arrivare alle ferite. La femmina beta invece, stazionava in disparte nella rocciata di sinistra, senza infastidire né essere infastidita. E qui stiamo parlando della fine di Settembre 2009.
Il 29 Settembre, notai innumerevoli piccole uova bianche adese alla cavità del tubo in PVC. La femmina era costantemente nei pressi dell’entrata ed il maschio pattugliava incessantemente il territorio intorno. Ma, purtroppo, appena qualche giorno dopo, le uova sparirono tutte. Non riuscii a capire cosa esattamente fosse successo, ma, lo stesso giorno, notai che si era momentaneamente formato un “trio”. C’era il maschio al centro del territorio, con una femmina (alfa, quella delle uova) nella tana di PVC e la seconda femmina (beta, leggermente più grande) nella tana di terracotta. E notai anche che ora il maschio sembrava concedere più attenzioni alla nuova arrivata, la F. beta. Tanto che nel giro di qualche giorno i ruoli si ribaltarono. La F. beta era divenuta “la prediletta”, mentre la F. alfa era relegata nella rocciata di sinistra. Era il 4 Ottobre. Stavolta però era più difficile capire cosa succedesse all’interno della tana, perché l’entrata del vasetto di terracotta è posta perpendicolarmente al vetro frontale della vasca. Quindi, per quanto tentassi di scrutarne l’interno, non vedevo che l’entrata.
Ma il 13 Ottobre ebbi una piacevolissima sorpresa. Vidi alcuni piccolissimi avannotti affacciarsi timidamente dalla tana. La mamma era sempre nei pressi della tana, mentre il maschio pattugliava con ancora maggior foga il territorio. Un paio di giorni dopo, gli avannotti si fecero più coraggiosi (anche grazie alla lastra di roccia che copriva e proteggeva la zona intorno alle tane) e mi ritrovai tante (una quarantina, credo) piccole “virgole” che setacciavano la sabbia in cerca di cibo. Ovviamente, dal giorno che vidi gli avannotti, non mancai di dosare in vasca abbondanti porzioni di naupli di artemia (con una siringa nei pressi della tana) e mangime polverizzato della SHG (“Excellent baby”). La loro crescita è risultata comunque abbastanza lenta ed ho assistito a innumerevoli perdite della nidiata. Quindi consiglio vivamente di spostare, il prima possibile, i piccoli in una vasca di accrescimento a parte, se se ne vogliono salvare il più possibile.
Questa, in sostanza, la mia esperienza con questi splendidi pesci, con la speranza che possa risultarvi utile e farvi non solo scegliere questa particolare specie, ma anche farvi appassionare alla loro riproduzione. Per qualsiasi dubbio o chiarimento, mi potete contattare sul Forum di Acquaportal (Entropy). |

















































































































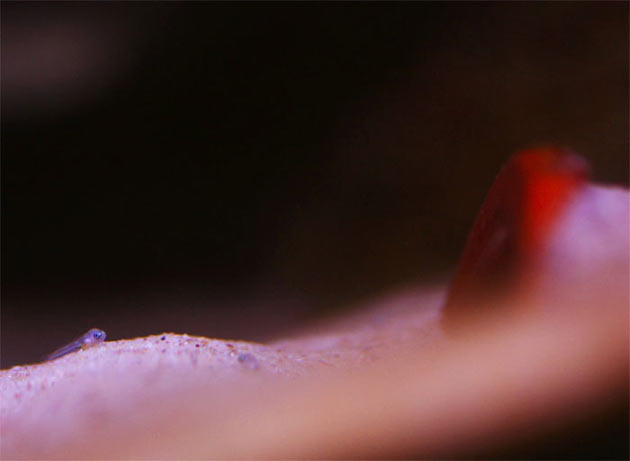
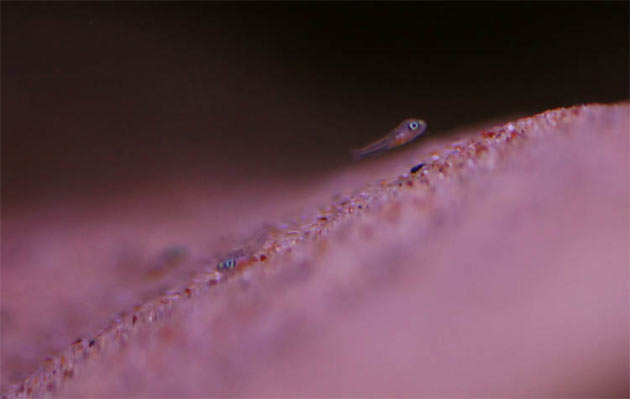
 Neolamprologus caudopunctatus, due foto del maschio alfa
Neolamprologus caudopunctatus, due foto del maschio alfa Neolamprologus caudopunctatus, femmina alfa
Neolamprologus caudopunctatus, femmina alfa